Neurodegenerative Erkrankungen wie Alzheimer oder die Parkinson Erkrankung zeichnen sich durch Proteinablagerungen in den Nervenzellen des Gehirns aus. Diese Proteinaggregate entstehen z.B. nach einer Mutation eines bestimmten Proteins, die zur Ausbildung von extrem stabilen amyloiden Fibrillen führt. Diese Fibrillen sind makroskopisch als Proteinverklumpung sichtbar und führen zu funktionalen Defekten und schließlich zum Absterben der betroffen Nervenzellen.
Die Alzheimer Krankheit wird durch die Fibrilisierung des Abeta Peptids und des tau Proteins hervorgerufen. Abeta Peptide entstehen bei jedem Menschen, aber nur ein relativ kleiner Bevölkerungsanteil erkrankt an Alzheimer. Der größte Risikofaktor? Das Alter. Bei den über 80-jährigen beträgt der Anteil der Alzheimererkrankten 20% und steigt auf 30-50% bei den 85-jährigen. Die Einzelmoleküle sind harmlos und erst wenn sie sich zusammenlagern, können sie toxische Aggregate bilden.
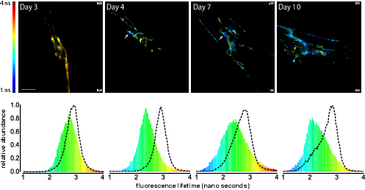
In den letzten Jahren zeigte sich, dass sich die Aggregation des Abeta Peptids über das gesamte Gehirn ausbreiten kann. Setzt sich diese Kaskade einmal in den Gang, kann man sie nicht mehr aufhalten oder gar umkehren. Bisher wusste man lediglich, dass die ersten fibrilären Abeta Aggregate in der Großhirnrinde und im Hippocampus des Gehirns auftreten. Aber wo genau die Aggregation beginnt, war unbekannt.
Der Arbeitsgruppe von Janine Kirstein gelang es nun, ein neues Tiermodell der Alzheimer Erkrankung im Fadenwurm Caenorhabditis elegans zu generieren. Mit Hilfe dieses Krankheitsmodells konnten ihre Mitarbeiter zeigen, dass die Aggregation des Abeta Peptids in genau 6 Nervenzellen, den IL2 Neuronen beginnt und sich von dort aus systematisch auf alle Nervenzellen ausweitet. Wäre es nun auch möglich, den Prozess der Übertragung auf die anderen Nervenzellen zu unterdrücken? Der Nematode ist genetisch leicht zugänglich und erlaubt zell-spezifische Manipulationen. Die AG Kirstein konnte zeigen, dass eine gezielte Inhibition der Abeta Aggregation in den IL2 Neuronen in der Tat die Aggregationskaskade und Übertragung auf andere Neuronen verlangsamt. Zudem konnte eine Reduktion der Toxizität und einer Erhöhung der medianen Lebensspanne beobachtet werden.
Lassen sich diese Erkenntnisse auf wesentlich komplexere Modellsysteme wie der Maus übertragen? Das wird sich zeigen. Die identifizierten IL2 Neuronen nutzen den gleichen Neurotransmitter (Acetylcholin) wie die Mehrheit der Neuronen der Gehirnareale, die zuerst von der Abeta Aggregation betroffen sind. Eine direkte Zuordnung der homologen Neuronen ist nicht möglich. Aber dennoch helfen die C. elegans Daten sehr, da man nun gezielt nach den „Start“-Neuronen in komplexeren Systemen suchen kann, um auch hier frühzeitig zu intervenieren, um so die Aggregationskaskade aufzuhalten. Diese Erkenntnisse sind damit sowohl für die Diagnostik als auch für die Entwicklung neuer therapeutischer Ansätze hoch relevant.
Die nächsten Schritte
Was macht die IL2 Neuronen so anfällig für Abeta Aggregation? Worin unterscheiden sich die IL2 Nervenzellen von anderen Neuronen? Wie erfolgt die Übertragung und Ausweitung der Abeta Aggregation zwischen den Nervenzellen?
Können wir unsere eigenen Schutzsysteme wie die molekularen Chaperone und Proteasen aktivieren, um eine Abeta Aggregation zu unterdrücken?
Publikation
Novel amyloid-beta pathology C. elegans model reveals distinct neurons as seeds of pathogenicity
Gallrein C, Iburg M, Michelberger T, Koçak A, Puchkov D, Liu F, Ayala Mariscal S, Nayak T, Kaminski Schierle G, Kirstein J
Progress in Neurobiology, 2020 Sep 11:101907
https://www.sciencedirect.com/science/article/pii/S030100822030162
Kontakt
Prof. Dr. Janine Kirstein
Fachbereich Biologie / Chemie
Zellbiologie
Universität Bremen